Étude clinique sur l'ABO-101 pour les patients avec hyperoxalurie primitive de type 1


Si vous êtes atteint(e) de HP1 et que vous souhaitez participer à un essai clinique, vous pourriez être éligible à la participation à l’étude redePHine, où que vous viviez dans le monde.
L’étude redePHine recherche des personnes atteintes d’hyperoxalurie primitive de type 1 (HP1) pour participer à une étude de recherche clinique sur un nouveau traitement par édition génomique.
L’ABO-101 est un médicament expérimental (ou médicament à l’étude) ; il s’agit d’une perfusion unique d’édition génomique qui vise à diminuer votre taux d’oxalate. Comme la HP1 entraîne un taux élevé d’oxalate, la réduction de ces taux peut aider à gérer les symptômes de cette affection.


Partager vos coordonnées pour nous permettre de prendre contact avec vous.

Vous devez remplir un questionnaire avec quelques premières vérifications initiales pour évaluer si vous pourriez potentiellement être éligible à l'étude redePHine. Ce questionnaire ne recueillera que les données médicales minimales nécessaires pour évaluer votre éligibilité potentielle à l'étude.

Si vous semblez potentiellement éligible selon les réponses au questionnaire de présélection, vous pouvez programmer un appel gratuit avec un navigateur patient. Votre navigateur patient évaluera plus en détail votre éligibilité potentielle à l'étude redePHine et vous fournira les informations et l'assistance nécessaire pour être orienté vers le centre d'étude, afin de déterminer votre éligibilité finale.
L’hyperoxalurie primitive de type 1 (HP1) est une maladie génétique rare causée par une mutation (modification de l’ADN) dans le gène AGXT. Cette mutation entraîne une production insuffisante d’une protéine spéciale par le foie, ce qui provoque un taux élevé d’oxalate. Normalement, l’oxalate peut être transformé et éliminé par les reins. Cependant, lorsque le taux d’oxalate devient trop élevé, cela peut entraîner la formation de cristaux qui peuvent s’agglomérer en calculs dans les voies urinaires et dans les reins. Les symptômes peuvent inclure une douleur en urinant, du sang dans les urines et des infections des voies urinaires. La formation chronique de calculs peut entraîner une maladie rénale et potentiellement évoluer vers une insuffisance rénale.
Si la fonction rénale se détériore de manière significative, l’oxalate peut s’accumuler dans d’autres parties du corps, entraînant la formation de cristaux dans des sites comme les yeux, la peau ou le cœur.
La HP1 est une maladie héréditaire, ce qui signifie qu’elle peut être transmise dans les familles.
Les options de prise en charge actuelles visent à réduire la formation de cristaux causée par la surproduction d’oxalate, ce qui contribue à ralentir les lésions rénales et à diminuer la formation de calculs. Votre médecin peut vous recommander de boire beaucoup, de modifier votre régime alimentaire et, dans certains cas, de prendre de la vitamine B6 (pyridoxine). Lorsqu’ils sont disponibles, votre médecin peut prescrire des médicaments pour réduire le taux d’oxalate dans l’urine (par exemple, le lumasiran [Oxlumo®] ou le nédosiran [Rivfloza®]). Si les calculs rénaux provoquent une douleur ou obstruent le flux urinaire, il peut être nécessaire de les retirer ou de les fragmenter pour qu’ils puissent passer dans l’urine. Chez certaines personnes atteintes de HP1, les reins peuvent fonctionner moins efficacement au fil du temps. Dans ces cas, un traitement appelé dialyse peut être recommandé.
Dans certains cas, une greffe de foie, avec ou sans greffe de rein, peut être considérée comme curative de la HP1. Cependant, il s’agit d’une intervention chirurgicale lourde avec des risques notables, notamment la nécessité d’une immunosuppression à vie, et elle n’est indiquée que pour certains patients.
La recherche de nouveaux traitements pour la HP1 est en cours.
L’édition génomique est un type de médicament génétique qui peut directement modifier des gènes individuels pour traiter une maladie.
Une des méthodes les plus étudiées s’appelle CRISPR. Cet outil peut trouver et modifier avec précision des gènes spécifiques.
L’ABO-101 est à l’étude comme traitement unique potentiel d’édition de gène par CRISPR.
L’édition génomique est autorisée par la Food and Drug Administration (FDA) aux USA pour le traitement de la drépanocytose ; en Europe, l’Agence européenne des médicaments (EMA) l’a autorisée pour la drépanocytose et la bêta-thalassémie.
L’édition génomique est également à l’étude dans d’autres régions pour l’amylose à transthyrétine (une maladie cardiaque et neurologique rare), l’hypercholestérolémie (taux élevé de cholestérol) et des troubles immunitaires.
Les essais cliniques sont des études de recherche clinique qui évaluent la sécurité, la tolérance et l’efficacité de traitements expérimentaux. Ils jouent un rôle essentiel dans le développement de traitements visant à améliorer la santé des patients. Regardez notre vidéo pour en savoir plus.
Les essais cliniques sont essentiels pour s’assurer que les traitements sont sûrs pour le public, déterminer les méthodes d’administration optimales et améliorer les connaissances scientifiques sur les maladies pour de meilleurs résultats médicaux.
Le terme « médicament expérimental » fait référence à un médicament à l’étude qui n’a pas encore reçu l’autorisation des agences réglementaires, comme la Food and Drug Administration (FDA) des USA et l’Agence européenne des médicaments (EMA). En conséquence, il ne peut être utilisé que dans des études de recherche clinique et n’est pas disponible pour une utilisation générale. Ces études visent à évaluer la sécurité et l’efficacité d’un médicament expérimental avant qu’il puisse potentiellement être autorisé pour un usage médical généralisé.
Les essais cliniques ont des critères spécifiques, appelés critères d’inclusion, qui déterminent qui peut y participer. Ces critères sont destinés à identifier les personnes qui présentent des symptômes spécifiques ou un diagnostic particulier, tout en excluant ceux pour qui la participation à l’essai serait inappropriée. En recrutant des participants dont les caractéristiques sont similaires, comme le type de mutation et la progression de la maladie, les critères d’éligibilité aux essais cliniques garantissent que les résultats de l’essai reflètent fidèlement les effets du médicament expérimental évalué. En outre, ces critères sont très importants pour assurer la sécurité des participants concernés.
Les essais cliniques comportent des risques potentiels comme des effets secondaires du traitement, une efficacité inconnue du traitement, des examens médicaux supplémentaires et des engagements en termes de temps. Ceux-ci sont soigneusement examinés et surveillés, et les risques et les bénéfices sont évalués par les comités d’éthique / comités de protection des personnes qui révisent et approuvent la réalisation de l’essai. Les essais cliniques respectent un ensemble spécifique de normes et sont étroitement réglementés afin d’assurer la sécurité de tous les participants. Les mesures de sécurité et les procédures de consentement éclairé sont destinées à aider les participants à comprendre et à gérer ces risques.
On peut avoir diverses raisons de participer à des essais cliniques. Certaines personnes peuvent participer parce qu’elles veulent en savoir plus sur leur maladie et les nouveaux traitements potentiels. D’autres se portent volontaires parce qu’elles désirent aider les chercheurs à en apprendre davantage sur le traitement d’une maladie, afin d’aider potentiellement d’autres personnes à l’avenir.
Oui. Les participants reçoivent des informations détaillées sur l’essai, peuvent poser des questions et prendre leur décision en toute liberté. Le consentement éclairé garantit qu’ils comprennent l’essai et qu’ils peuvent quitter l’essai à tout moment sans que cela affecte leurs soins ou leurs droits.
Chez myTomorrows, nous attribuons un navigateur patient dédié à chaque patient. Votre navigateur patient vous assistera tout au long du processus, de l’évaluation de votre éligibilité à l’essai, en répondant à toutes les questions que vous pourriez avoir pendant votre parcours dans l’essai clinique. Nos navigateurs patient sont des professionnels qui ont reçu une formation médicale et qui sont étroitement supervisés par notre équipe de médecins. Bien qu’ils soient formés pour expliquer des concepts médicaux complexes, ils ne peuvent pas donner des avis médicaux. Notre équipe de navigateurs patient offre un support fiable et multilingue couvrant tous les fuseaux horaires, afin d’assurer une communication et une compréhension efficaces avec les patients de diverses origines.
Oui, en plus de fournir des services de présélection pour des essais cliniques spécifiques, myTomorrows offre également d’autres services gratuits concernant la fourniture d’informations impartiales sur les essais cliniques ou d’autres options de traitement avant autorisation et la manière d’y accéder. C’est toujours gratuit.
L’objet de cette étude est d’évaluer la sécurité, la tolérabilité et l’efficacité préliminaire d’un médicament expérimental d’édition génomique chez les personnes atteintes d’hyperoxalurie primitive de type 1 (HP1).
Il s’agit d’une étude d’escalade de dose, ce qui signifie qu’elle impliquera d’évaluer plusieurs doses différentes du médicament. Les premiers participants adultes recevront une faible dose. Si cette dose est bien tolérée, le groupe de participants suivant recevra une dose intermédiaire ; si cette dose est également bien tolérée, une dose plus élevée sera administrée au groupe suivant. Cette méthode nous aide à déterminer la dose la plus sûre et la plus efficace. Quand nous aurons déterminé une dose sûre et efficace chez l’adulte, tous les participants suivants recevront cette dose, y compris les patients pédiatriques.
L’ABO-101, un traitement expérimental potentiel unique d’édition génomique CRISPR, est le médicament à l’étude évalué dans l’étude redePHine.
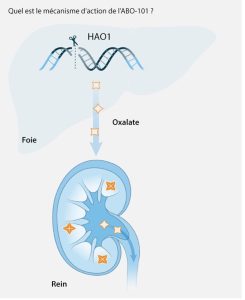
L’ABO-101 est un traitement expérimental potentiel d’édition génomique unique CRISPR destiné à modifier spécifiquement le gène HAO1 afin de l’empêcher d’agir de manière permanente. Des études cliniques antérieures sur la HP1 ont montré que l’inhibition du gène HAO1 diminue le taux d’oxalate chez les personnes atteintes de HP1. Comme la HP1 augmente le taux d’oxalate, la réduction de ce taux peut contribuer à gérer les symptômes de cette maladie et réduire le risque de calculs rénaux et de lésions rénales.
Oui, tous les participants à l’étude de recherche clinique recevront le traitement expérimental. Il n’y a pas d’administration de placebo dans cette étude.
Les participants adultes peuvent recevoir une dose faible, moyenne ou élevée du médicament. Quand nous aurons déterminé une dose sûre et efficace chez les adultes, tous les participants suivants recevront cette dose expérimentale, y compris les patients pédiatriques.
Les participants éligibles doivent :
Il y a des critères supplémentaires, que le médecin de l’étude expliquera aux personnes potentiellement éligibles qui souhaitent participer.
Si vous êtes potentiellement éligible, vous pouvez être mis(e) en relation avec le centre d’étude le plus proche de chez vous afin de minimiser les déplacements et les complications. Cependant, si vous devez voyager à l’échelle nationale ou internationale, un remboursement des frais vous sera accordé afin de faciliter votre participation. Le centre d’étude s’assurera que vous recevrez ce remboursement.
Pendant la première phase de l’étude, vous recevrez une dose unique du médicament à l’étude (ABO-101) et votre état de santé sera étroitement surveillé au cours des 2 premières années. Ensuite, il y aura une phase de suivi à long terme pouvant durer jusqu’à 13 ans après l’administration du médicament à l’étude (ABO-101) afin d’évaluer sur le long terme la sécurité et l’efficacité de ce nouveau traitement par édition génomique.
Cette étude comportera les phases suivantes :
S’il n’y a pas de centre d’étude près de chez vous, vous pourrez quand même participer à cette étude. Les dépenses et les frais de déplacement seront pris en charge pour faciliter votre participation. Le centre d’étude s’assurera que vous recevrez ce remboursement.

 Centres d'études regroupés (> 10)
Centres d'études regroupés (> 10)
 Centres d'études regroupés (< 10)
Centres d'études regroupés (< 10)
 Les centres d'études qui recrutent
Les centres d'études qui recrutent
 Les centres d'études se préparent à recruter
Les centres d'études se préparent à recruter
Les pages suivantes comportent quelques questions de présélection pour déterminer si vous (le patient) pouvez être éligible à la participation à l’étude d recherche clinique redePHine. Si vous souhaitez participer à la présélection, vous devrez fournir certaines informations personnelles et des informations sur votre état de santé. Si vous répondez aux questions au nom du patient, veuillez indiquer vos coordonnées personnelles et répondre à toute question médicale comme si vous étiez le patient.
Arbor Biotechnologies, Inc., est le promoteur de cette étude et est responsable d’assurer la sécurité et la confidentialité de vos informations personnelles, conformément à toutes les réglementations applicables en matière de protection des données, et peut être contacté à l’adresse privacy@arbor.bio. Arbor Biotechnologies a engagé myTomorrows (« myTomorrows », « nous ») et Worldwide Clinical Trials pour aider au recrutement de l’essai clinique en recueillant des informations de présélection pour l’étude via ce site Web.
Nous utiliserons ces informations, avec votre consentement, pour évaluer votre éligibilité potentielle à l’étude.
Après avoir répondu aux questions de présélection, vous aurez l’occasion de prendre rendez-vous avec l’un de nos navigateurs patient, qui recueillera des informations supplémentaires sur votre état de santé pour évaluer votre éligibilité à cet essai, et des informations sur vos possibilités de déplacement et vos préférences afin d’organiser votre renvoi à un centre d’essai clinique, si vous êtes éligible à l’étude. Si nous déterminons que vous pourriez être éligible à cette étude, nous partagerons vos informations personnelles avec un centre d’essai clinique, qui pourrait partager vos informations personnelles avec Scout Clinical, un autre fournisseur d’Arbor Biotechnologies, si nécessaire pour vous aider à organiser votre déplacement.

Si nous déterminons que vous pouvez être éligible à l’essai, vos données peuvent être transférées et conservées à l’échelle internationale, y compris dans des pays où les lois sur la protection des données peuvent être différentes de celles du pays où nous recueillons vos informations personnelles. Cependant, le promoteur est tenu de s’assurer que des procédures de sécurité et de contrôle organisationnel adéquates sont mises en œuvre par toute partie, y compris myTomorrows, qui peut accéder à vos informations personnelles, afin de s’assurer que vos informations personnelles continueront à être protégées au même niveau que dans le pays où elles sont recueillies.
Nous conserverons toutes les informations que vous fournissez sur ce site Web aussi longtemps que nécessaire pour répondre aux objectifs indiqués plus haut, conformément aux lois applicables, ou pendant une durée de deux ans si vous n’êtes pas éligible et si vous acceptez que nous les conservions pour vous contacter au sujet de changements d’éligibilité pour cette étude ou de futures études d’Arbor Biotechnologies.
Les informations que nous recueillons à votre sujet ne seront pas partagées avec Arbor Biotechnologies ou Worldwide Clinical Trials de quelque manière que ce soit qui pourrait vous identifier. Seules les données agrégées seront communiquées à Arbor Biotechnologies et à Worldwide Clinical Trials.
Vous pouvez retirer votre consentement à tout moment et, en cas de retrait de votre consentement, nous supprimerons rapidement vos données à caractère personnel, sauf dans la mesure requise pour nous conformer à nos obligations légales.
À tout moment, vous avez le droit d’accéder et d’obtenir une copie des données à caractère personnel détenues par myTomorrows ou le promoteur. Vous avez également le droit de demander la rectification ou la suppression de vos données à caractère personnel détenues par myTomorrows ou le promoteur. Si vous souhaitez retirer votre consentement ou exercer un de ces droits, contactez myTomorrows à l’adresse dataprotection@mytomorrows.com qui vous informera sur la procédure appropriée. Si vous estimez que vos informations personnelles n’ont pas été ou ne sont pas traitées conformément à la réglementation applicable, vous avez le droit de déposer une plainte auprès d’une autorité de contrôle de la protection des données. Dans ce cas, myTomorrows est tenu de vous fournir les coordonnées appropriées pour que vous puissiez déposer votre plainte.

